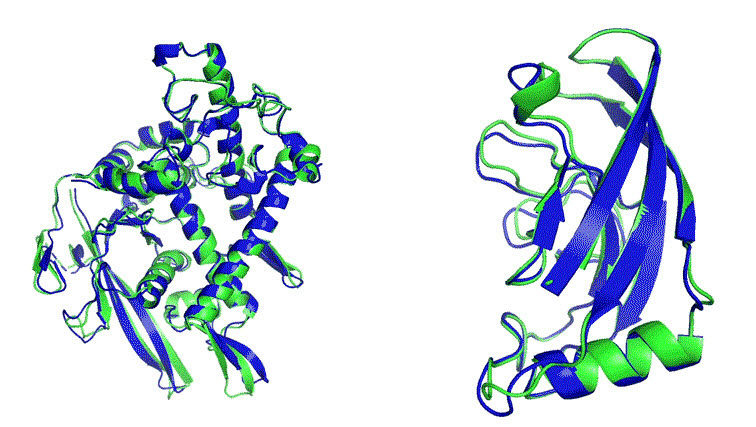
 |
| 알파폴드2가 예측한 이미지 구조. |
 |
| 이창훈 교수 (뉴바이올로지 전공) |
대구경북과학기술원(DGIST) 뉴바이올로지전공 이창훈 교수는 생화학자이며 구조생물학자다. 피부를 비롯한 생명체의 경계 구조와 단백질 구조를 연구하고 있으며, 이를 통해 신약을 설계하고 질병을 치료하는 전략을 개발하고 있다.
2000년 연세대 이과대학 자연과학부를 졸업하고, 연구실과 회사에 근무하면서 학자가 되고자 하는 꿈을 키우게 되었다. 2009년 미국 존스홉킨스대(The Johns Hopkins University) 의과대학에서 생화학 박사 학위를 취득하였고, 동 대학의 공중보건대에서 박사후 연수연구원으로 생화학 및 분자생물학 연구를 수행하였다.
DGIST에 부임한 2012년부터 실험실을 개설한 2020년까지 DGIST 융복합대학 기초학부에서 학부 전담 교수로 활동하면서 학생들이 즐겁게 공부할 수 있는 생명과학 교육 과정과 실험 실습 교육을 실현하는데 노력하였다. 상담경력개발센터장으로 활동했던 경험을 바탕으로 학문 후속세대의 성장과 역량 발전에도 관심과 노력을 기울이고 있다.
우리 몸은 여러 종류의 분자로 이루어져 있다. 그중에서도 단백질은 우리 몸의 구조를 유지하거나 다양한 기능을 수행하는 중추적인 역할을 하고 있다. 머리카락이나 손발톱, 피부와 같은 주요 구조물을 이루는 단백질이 유전적 결함이나 환경적인 영향으로 인하여 제 역할을 하지 못하면 우리는 이들 구조물을 제대로 지탱하지 못한다. 소화 효소나 대사 조절에 중요한 단백질의 기능을 잃게 되면, 소화 기능이나 정상적인 대사 기능도 저하된다.
또 활성화되지 않아야 할 맥락에서 활성화되는 단백질도 우리 몸을 해칠 수 있다. 세포 분열이나 생장을 촉진하는 단백질이 과발현되거나 제어되지 않으면 암이 발생할 수도 있다. 암은 본래의 맥락에서 벗어나 활성화된 단백질의 해악을 보여주는 여러 예시 중 하나다.
그래서 우리는 단백질이 제 역할을 하도록 돕는 촉진제를 찾거나, 원치 않는 기능을 줄여주는 저해제를 찾아 약물로 활용하기도 한다. 좋은 치료제를 찾는 과정은 질병과 관련된 단백질을 제대로 이해하는 과정에서 시작되는 경우가 많다.
단백질을 이해하는 다양한 방식이 있지만, 생화학자들과 구조생물학자들은 단백질의 형태를 살펴보는 방식을 선호한다. 단백질이 제 기능을 하려면 그에 적합한 형태, 즉 분자 구조를 제대로 갖추어야 한다.
야구 글러브가 손을 넣는 공간과 공을 잡는 공간을 달리 가지며, 유연하게 접히는 곳과 단단하게 고정된 곳을 가지는 것은 최종 목표(야구공을 잡는 기능)를 달성하기 위한 구조를 형성하기 위함이다. 포도당을 분해하는 효소는 포도당 분자를 품을 수 있는 공간을 가지며, 그 공간의 표면은 포도당과 화학적으로 잘 결합하기 위한 아미노산 화합물로 꾸며져 있다. 만약 포도당을 분해하는 효소가 포도당 수용 공간을 좁게 만들거나 표면 구조를 엉뚱하게 만들면, 그 효소는 포도당과 결합하지 못하고 포도당을 분해하는 기능도 수행하지 못하게 된다. 만약, 우리가 포도당 분해효소의 구조를 원자 단위로 이해한다면, 포도당과 닮은 화합물을 원자 단위로 설계할 수도 있다. 이러한 화합물을 만들어 세포 속에 넣는다면, 포도당 분해 효소는 구조적으로 닮은 인공 분자와 결합하는 데 시간을 보내면서 본래의 포도당 분해 기능을 제대로 수행하지 못할 것이다.
위에서 설명한 예시처럼 생명과학자들은 단백질의 '구조-기능 상관관계'를 연구함으로써 그 단백질이 수행하는 일들을 좀 더 깊이 이해하려 한다. 단백질의 구조-기능 연구 중에서 가장 흥미로운 부분 중 하나는 단백질 분자를 구성하는 모든 원자들의 3차원 위치를 파악하는 것이다. 우리가 사는 세상은 3차원 공간에서 직관적으로 이해되며, 이는 단백질 역시 마찬가지다. 구조생물학자들은 X선이나 마이크로웨이브 파와 같은 독특한 빛과 분광 장비를 활용하여 단백질을 이루는 원자들의 위치를 3차원 좌표계(학교에서 배우는 데카르트 직교 좌표계)에 모두 찍어내고 이를 PDB (Protein Data Bank)라는 파일로 정리한다. 우리가 문서 작성에 사용하는 한글 파일(.hwp)이나 워드 파일(.doc)처럼 PDB 파일은 '.pdb'라는 확장자를 가지고 있으며 이 파일을 문서로 열어보면 단백질을 구성하는 원자들과 그 3차원 좌표들이 나열되어 있다.
PDB 구조 자료가 지속해서 쌓이면서 과학자들은 분광 실험 없이도 단백질 구조를 예측할 수 있지 않을까 하는 생각을 하게 되었다. 즉, 단백질을 구성하는 아미노산 조합(서열)만 알고 있으면, 단백질을 구성하는 모든 원자의 3차원 위치도 계산할 수 있으리라는 가설이다. 과학자들은 상당한 양의 PDB를 분석하면서 특정 아미노산의 조합이 일정한 형태의 3차원 구조를 가지리라는 자연계의 패턴을 조금씩 알게 되었다.
만약 우리가 분석할 수 있는 PDB 정보를 충분히 많이 가지고 있고, 그 정보를 열심히 학습할 수 있다면, 자연이 단백질을 형성하는 패턴을 더 알아낼 수 있을 것이다. 마치 바둑의 기본 원리를 바탕으로 많은 수의 기보를 분석하며 학습하면 바둑의 패턴을 이해하는 것과 비슷할 것이다. 그리고 바둑과 마찬가지로, 단백질 구조 형성의 패턴은 사람이 아닌 기계가 분석하고 학습해도 될 것이다. 인공지능을 통해 단백질 구조 예측이 가능하다고 믿는 이유다.
알파고를 통해 바둑계에 충격을 준 딥마인드는 올해 구조생물학계에 큰 충격을 주었다. 알파폴드 2라는 단백질 구조 예측 도구를 통해 단백질 구성 원자의 위치들을 실험 관측값과 매우 비슷하게 계산해 냈기 때문이다. 격년 단위로 열리는 구조 예측 대회 'CASP'에서 알파폴드 2는 모든 인간 참가자들을 제치고 압도적인 예측 결과로 1위를 차지하였다. 앞으로 딥마인드의 알파폴드2가 단백질의 구조-기능 상관 관계를 '실험 없이' 예측할지도 모른다는 의미이며, 생화학자들과 구조생물학자들이 실험을 통해 구조를 연구하는 기존 방법을 바꾸어야 한다는 의미다. 아울러 예측된 단백질 구조에 잘 결합하는 저해제 또는 촉진제를 인공지능이 계산하는 시기도 앞당겨질 것이다. 구조 기반 신약설계는 사람의 두뇌 속이 아닌 컴퓨터 안에서 이루어질 것이다. 바둑을 두며 승률을 계산하던 알파고처럼, 신약설계를 수행하는 다음 세대의 알파폴드는 설계 약물의 효능을 수치화된 예측 결과로 알려줄 것이다.
1980년대 초에 AIDS를 일으키는 HIV 바이러스가 알려진 이래, 관련 단백질의 구조를 밝힘으로써 그 치료제를 설계하고 현실화하는데 거의 20여년이 걸렸다. 그런데 2019년 말에 퍼지기 시작한 COVID-19 바이러스의 주요 단백질 구조는 2020년 1월에 학계에 발표되었고, 원자 수준으로 치료제 설계가 가능한 정도의 구조 정보는 지속해서 공유되고 있다. 바이러스 단백질의 구조를 예측하고 설계하는 인공 지능 기술이 접목된다면, 인류는 감염증 위협에서 더 빨리 벗어날 수 있을 것이라는 희망도 가져본다. 적어도 생명과학 분야에서, 좀 더 보수적으로 신약 설계 분야에서 인공지능은 인류에게 새로운 희망을 줄지도 모른다.
이창훈 교수 (뉴바이올로지 전공)
영남일보(www.yeongnam.com), 무단전재 및 수집, 재배포금지




